Продолжающееся распространение коронавирусной болезни 2019 года (COVID-19) вызвало широкую озабоченность во всем мире, и 11 марта 2020 года Всемирная организация здравоохранения (ВОЗ) объявила COVID-19 пандемией. Исследования тяжелого острого респираторного синдрома (SARS) и ближневосточного респираторного синдрома (MERS) показали, что вирусоспецифические антитела выявлялись у 80–100% пациентов через 2 недели после появления симптомов 1 , 2 , 3 , 4 , 5 , 6 . В настоящее время ответы антител против SARS-CoV-2 остаются плохо изученными, и клиническая полезность серологического тестирования неясна 7 .
В общей сложности 285 пациентов с COVID-19 были включены в это исследование из трех назначенных больниц; 70 из этих пациентов имели последовательные образцы. Характеристики этих пациентов приведены в дополнительных таблицах 1 и 2 . Мы провели валидацию и использовали магнитно-хемилюминесцентный иммуноферментный анализ (MCLIA) для выявления вирус-специфических антител (расширенные данные, рис. 1a-d и дополнительная таблица 3 ). Образцы сыворотки от пациентов с COVID-19 показали отсутствие перекрестного связывания с субъединицей S1 спайкового антигена SARS-CoV. Однако мы наблюдали некоторую перекрестную реактивность образцов сыворотки пациентов с COVID-19 на нуклеокапсидные антигены SARS-CoV (Расширенные данные, рис. 1e).). Доля пациентов с положительным вирус-специфическим IgG достигла 100% приблизительно через 17–19 дней после появления симптомов, тогда как доля пациентов с положительным вирус-специфическим IgM достигла пика 94,1% приблизительно через 20–22 дня после появления симптомов (рис. 1а и Методы ). В течение первых 3 недель после появления симптомов наблюдалось увеличение титров вирус-специфических антител IgG и IgM (рис. 1б ). Тем не менее, IgM показал небольшое снижение в> 3-недельной группе по сравнению с ≤3-недельной группой (рис. 1b ). Титры IgG и IgM в тяжелой группе были выше, чем в нетяжелой группе, хотя значительная разница наблюдалась только в титре IgG в 2-недельной группе после появления симптомов (Рис. 1c ,P = 0,001).Шестьдесят три пациента с подтвержденным COVID-19 находились под наблюдением до выписки. Образцы сыворотки собирали с 3-дневными интервалами. Среди них общий уровень сероконверсии составил 96,8% (61/63) в течение периода наблюдения. Два пациента, мать и дочь, сохраняли IgG- и IgM-отрицательный статус во время госпитализации. Серологические курсы можно было наблюдать для 26 пациентов, которые первоначально были серонегативными, а затем перенесли сероконверсию в течение периода наблюдения. Все эти пациенты достигли сероконверсии IgG или IgM в течение 20 дней после появления симптомов. Средний день сероконверсии для IgG и IgM составлял 13 дней после появления симптомов. Наблюдалось три типа сероконверсии: синхронная сероконверсия IgG и IgM (девять пациентов),2а ). Продольные изменения антител у шести репрезентативных пациентов с тремя типами сероконверсии показаны на рис. 2b-d и расширенные данные рис. 2a-c .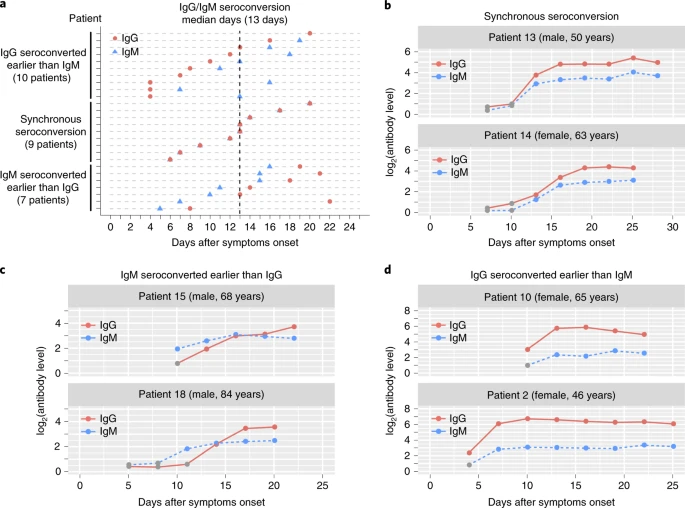 Уровни IgG у 19 пациентов, перенесших сероконверсию IgG во время госпитализации, достигли плато через 6 дней после первого положительного измерения IgG (расширенные данные, рис. 3 ). Уровень плато IgG варьировал в широких пределах (более чем в 20 раз) у пациентов. IgM также показал аналогичный профиль динамических изменений (расширенные данные рис. 4 ). Мы не обнаружили никакой связи между уровнем плато IgG и клиническими характеристиками пациентов (расширенные данные, рис. 5a – d).). Далее мы проанализировали, подходят ли критерии подтверждения инфекции MERS-CoV, рекомендованные ВОЗ, включая (1) сероконверсию или (2) четырехкратное увеличение титров IgG-специфических антител, для диагностики COVID-19 (с использованием парных образцов из 41 пациент). Первоначальный образец был собран в первую неделю болезни, а второй - через 2-3 недели. Из пациентов, чей IgG был первоначально серонегативным в первую неделю болезни, 51,2% (21/41) перенесли сероконверсию. Всего 18 пациентов были первоначально серопозитивными в первую неделю болезни; из них у восьми пациентов было четырехкратное увеличение вирус-специфических титров IgG (расширенные данные, рис. 6)). В целом, 70,7% (29/41) пациентов с COVID-19 соответствовали критериям сероконверсии IgG и / или четырехкратному увеличению или увеличению титров IgG.
Уровни IgG у 19 пациентов, перенесших сероконверсию IgG во время госпитализации, достигли плато через 6 дней после первого положительного измерения IgG (расширенные данные, рис. 3 ). Уровень плато IgG варьировал в широких пределах (более чем в 20 раз) у пациентов. IgM также показал аналогичный профиль динамических изменений (расширенные данные рис. 4 ). Мы не обнаружили никакой связи между уровнем плато IgG и клиническими характеристиками пациентов (расширенные данные, рис. 5a – d).). Далее мы проанализировали, подходят ли критерии подтверждения инфекции MERS-CoV, рекомендованные ВОЗ, включая (1) сероконверсию или (2) четырехкратное увеличение титров IgG-специфических антител, для диагностики COVID-19 (с использованием парных образцов из 41 пациент). Первоначальный образец был собран в первую неделю болезни, а второй - через 2-3 недели. Из пациентов, чей IgG был первоначально серонегативным в первую неделю болезни, 51,2% (21/41) перенесли сероконверсию. Всего 18 пациентов были первоначально серопозитивными в первую неделю болезни; из них у восьми пациентов было четырехкратное увеличение вирус-специфических титров IgG (расширенные данные, рис. 6)). В целом, 70,7% (29/41) пациентов с COVID-19 соответствовали критериям сероконверсии IgG и / или четырехкратному увеличению или увеличению титров IgG.
Чтобы выяснить, может ли серологическое тестирование помочь идентифицировать пациентов с COVID-19, мы провели скрининг 52 подозреваемых случаев у пациентов, у которых были обнаружены симптомы COVID-19 или аномальные рентгенологические результаты и у которых тестирование на вирусную РНК было отрицательным по крайней мере в двух последовательных образцах. Из 52 подозреваемых случаев у четырех были вирус-специфические IgG или IgM в исходных образцах (расширенные данные, рис. 7).). Пациент 3 имел более чем четырехкратное увеличение титра IgG через 3 дня после первоначального серологического исследования. Интересно, что пациент 3 также дал положительный результат на вирусную инфекцию с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) между двумя измерениями антител. Титр IgM увеличивался в течение трех последовательных образцов от пациента 1 (<в 4 раза). Пациент 4 имел в 100 раз более высокие IgG и в 10 раз более высокие титры IgM, чем пороговые значения в двух последовательных образцах. Пациент 2 дал положительный результат на вирус-специфический IgG и IgM. Увеличение IgG и / или IgM в последовательных образцах или положительный результат в одном образце, собранном через 2 недели после появления симптомов, позволяют предположить, что эти три пациента были инфицированы SARS-CoV-2.
Мы также продемонстрировали применение серологического тестирования в эпиднадзоре в кластере из 164 близких контактов пациентов с известным COVID-19. Было подтверждено, что шестнадцать человек были инфицированы SARS-CoV-2 с помощью ОТ-ПЦР, а в трех случаях симптомы отсутствовали. Другие 148 человек имели отрицательные результаты ОТ-ПЦР и никаких симптомов (расширенные данные Рис. 8). Образцы сыворотки были отобраны у этих 164 индивидуумов для тестов на антитела через 30 дней после воздействия. Все 16 подтвержденных ОТ-ПЦР случаев были положительными для вирус-специфического IgG и / или IgM. Кроме того, 7 из 148 человек с отрицательными результатами ОТ-ПЦР имели положительные вирус-специфические IgG и / или IgM, что указывает на то, что 4,3% (7/164) тесных контактов были пропущены тестом на нуклеиновую кислоту. Десять из 164 близких контактов, которые имели положительные вирус-специфические IgG и / или IgM, были бессимптомными.
Наше исследование показало, что критерии подтверждения инфекции MERS-CoV подходят для большинства пациентов с COVID-19. Тем не менее, для того чтобы эти пациенты соответствовали этим критериям, необходимо как можно раньше собрать первый образец сыворотки, поскольку 12,2% (5/41) пациентов уже имели плато в титре IgG в течение 7 дней после появления симптомов (расширенные данные, фиг. . 6 ). Для тех пациентов, которые не были отобраны во время идеального окна, потребовались бы повторные серологические тесты, чтобы подтвердить ответ антител на инфекцию SARS-CoV-2.
Наше исследование имеет некоторые ограничения. Во-первых, мы не тестировали образцы на нейтрализацию вируса, и поэтому нейтрализующие активности обнаруженных антител IgG неизвестны. Во-вторых, из-за небольшого размера выборки пациентов в тяжелом и критическом состоянии трудно определить связь между реакцией антител и клиническим течением.
Обнаружение вирусной РНК на основе ОТ-ПЦР чувствительно и может эффективно подтвердить раннюю инфекцию SARS-CoV2 8 . Наши данные указывают на то, что обнаружение вирус-специфических антител к COVID-19 может быть важным (1) в качестве дополнения к тестированию нуклеиновых кислот для диагностики подозрительных случаев с отрицательными результатами ОТ-ПЦР и (2) при обследовании на наличие бессимптомной инфекции в тесных контактах , Подтверждение подозреваемых случаев COVID-19 как можно раньше с помощью серологического тестирования может снизить риск воздействия при повторном отборе проб и сохранить ценные тесты ОТ-ПЦР. В нашем мелкомасштабном опросе семь случаев с отрицательными результатами по нуклеиновой кислоте и без симптомов показали положительный IgG и / или IgM. Это подчеркивает важность серологического тестирования для достижения более точных оценок степени пандемии COVID-19.
методы
Дизайн исследования
В общей сложности 285 пациентов с COVID-19 были включены в это перекрестное исследование из трех назначенных больниц в Чунцине, провинциальном муниципалитете, прилегающем к провинции Хубэй, который был отправной точкой и эпицентром эпидемии COVID-19. Эти три больницы - Центральная больница Чунцин Три Ущелья (TGH), Больница Юнчуань, филиал Медицинского университета Чунцина (CQMU) (YCH) и Медицинский центр общественного здравоохранения Чунцина (CQPHMC) - были назначены муниципальным народным правительством Чунцина принимать пациентов из трех стран. обозначенные районы. Все зарегистрированные пациенты были подтверждены инфицированием SARS-CoV-2 с помощью ОТ-ПЦР-анализов на образцах мазков из носа и глотки. Средний возраст этих зарегистрированных пациентов составлял 47 лет (IQR, 34–56 лет), и 55,4% были мужчинами. Среди них 250 пациентов имели эпидемиологический анамнез, в то время как 262 пациента имели четкую запись появления симптомов, а 70 пациентов имели множественные образцы сыворотки. Всего в анализ было включено 363 образца сыворотки от пациентов с отчетливым анамнезом. Из 285 пациентов 39 были классифицированы как находящиеся в тяжелом или критическом состоянии в соответствии с Протоколом диагностики и лечения новой коронавирусной пневмонии (пробная версия 7), выпущенным Национальной комиссией здравоохранения и Государственным управлением традиционной китайской медицины. Для контрольной группы были взяты пробы сыворотки от 63 пациентов в ГК с интервалами в 3 дня с 8 февраля 2020 года до выписки из больницы. Чтобы проанализировать, подходят ли серологические критерии подтверждения MERS-CoV, рекомендованные ВОЗ, для диагностики COVID-19, для скрининга пациентов были установлены два критерия включения: (1) первый образец сыворотки, собранный в течение первой недели после начала заболевания, или (2) первый образец сыворотки, собранный в течение не менее 7 дней после начала заболевания, но с отрицательным IgG. Тридцать четыре пациента соответствовали критерию 1, и семь пациентов соответствовали критерию 2.
Чтобы оценить потенциал серологического теста в диагностике COVID-19, мы зарегистрировали 52 пациента с подозрением на COVID-19, поступивших в Народную больницу Ваньчжоу (Чунцин, Китай), у которых были респираторные симптомы или аномальная легочная томография, но отрицательная ОТ-ПЦР приводила к минимум два последовательных теста. Образцы сыворотки собирали в момент времени , указанный в данных расширенной рис. 7 и антител против-2-коронавирус SARS были испытаны.
Серологическое исследование было выполнено в группе тесных контактов, состоящей из 164 человек, определенных местным центром по контролю и профилактике заболеваний (Ваньчжоу, Чунцин). Пара, которая вернулась из города Ухань и была подтверждена заражением SARS-CoV-2 4 февраля 2020 года, считалась пациентами первого поколения в этой контактной сети. Все остальные случаи в этой группе имели тесный контакт (прямо или косвенно) с этой парой в период с 20 января по 6 февраля 2020 года. 1 марта были взяты образцы сыворотки из этих 164 случаев для анализа на антитела.
Определения
Пациенты с эпидемиологическим анамнезом определялись следующим образом: жители Ухани; недавно был в Ухане (30 дней до появления симптомов); местный житель, который имел контакт с подтвержденными случаями. Сероконверсию определяли как переход результатов теста на IgG или IgM против SARS-CoV-2 от отрицательных к положительным результатам в последовательных образцах. Уровни антител были представлены как измеренные значения хемилюминесценции, разделенные на порог (поглощение / отсечка, S / CO): S / CO> 1 был определен как положительный, а S / CO ≤ 1 как отрицательный.
Обнаружение IgG и IgM против SARS-CoV-2
Для измерения уровня IgG и IgM против SARS-CoV-2 у пациентов отбирали образцы сыворотки. Все образцы сыворотки инактивировали при 56 ° С в течение 30 мин и хранили при -20 ° С перед тестированием. IgG и IgM против SARS-CoV-2 в образцах плазмы были протестированы с использованием наборов MCLIA, поставляемых Bioscience Co. (одобрено Национальным управлением медицинской продукции Китая; номера одобрения 20203400183 (IgG) и 20203400182 (IgM)), в соответствии с инструкциями производителя. , MCLIA для определения IgG или IgM был разработан на основе сэндвич-иммуноанализа с двумя антителами. Рекомбинантные антигены, содержащие нуклеопротеин и пептид из белка шипа SARS-CoV-2, были конъюгированы с FITC и иммобилизованы на магнитных частицах, конъюгированных с антителами против FITC. Антитело против IgG / IgM человека, конъюгированное с щелочной фосфатазой, использовали в качестве детектирующего антитела. Испытания проводились на автоматическом магнитном хемилюминесцентном анализаторе (Axceed 260, Bioscience) в соответствии с инструкциями производителя. Все испытания проводились в строгих условиях биобезопасности. Титр антител тестировали один раз на образец сыворотки. Уровни антител представлены в виде измеренных значений хемилюминесценции, разделенных на пороговое значение (S / CO). Значение отсечки этого теста определялось кривыми рабочих характеристик приемника. Уровни антител на фигурах рассчитывали как log Уровни антител представлены в виде измеренных значений хемилюминесценции, разделенных на пороговое значение (S / CO). Значение отсечки этого теста определялось кривыми рабочих характеристик приемника. Уровни антител на фигурах рассчитывали как log Уровни антител представлены в виде измеренных значений хемилюминесценции, разделенных на пороговое значение (S / CO). Значение отсечки этого теста определялось кривыми рабочих характеристик приемника. Уровни антител на фигурах рассчитывали как log2 (S / CO + 1).
Оценка эффективности SARS-CoV-2-специфического анализа определения IgG / IgM
Точность и воспроизводимость комплектов MCLIA были впервые оценены Национальными институтами по контролю за продуктами и лекарствами. Кроме того, было протестировано 30 образцов сыворотки от пациентов с COVID-19, демонстрирующих разные титры IgG (диапазон 0,43–187,82) и IgM (диапазон 0,26–24,02). Каждый отдельный образец был протестирован в трех независимых экспериментах, и коэффициент вариации (CV) был использован для оценки точности анализа. Наконец, 46 образцов сыворотки от пациентов с COVID-19 были оценены с использованием различных партий диагностического набора для специфичных к SARS-CoV-2 антител IgG или IgM; Воспроизводимость была рассчитана на основе результатов двух серийных экспериментов.
Перекрестная реактивность антигенов от SARS-CoV и SARS-CoV-2
Два рекомбинантных белка нуклеокапсида (N) SARS-CoV из двух разных источников (Sino Biological, номер по каталогу 40143-V08B; Biorbyt, номер по каталогу orb82478), рекомбинантная субъединица S1 шипа SARS-CoV (Sino Biological, cat № 40150-V08B1) и самодельный рекомбинантный N-белок SARS-CoV-2 использовали в иммуноферментном хемилюминесцентном анализе (CLEIA) соответственно. Концентрация антигенов, использованных для покрытия планшетов, составляла 0,5 мкг мл -1 . Разведение козьего антитела против человеческого IgG, конъюгированного с щелочной фосфатазой, составляло 1: 2500. Пять образцов сыворотки от пациентов с COVID-19 и пять образцов сыворотки от здоровых контролей разводили (1:50) и тестировали с использованием анализов CLEIA. Способность антитела связываться с антигеном в образце измеряли в относительных единицах люминесценции.
Статистический анализ
Непрерывные переменные выражаются как медиана (IQR) и сравниваются с U- тестом Манна-Уитни . Категориальные переменные выражаются в виде чисел (%) и сравниваются с помощью точного критерия Фишера. Значение P <0,05 считалось статистически значимым. Статистический анализ был выполнен с использованием программного обеспечения R, версия 3.6.0.
Этическое одобрение
Исследование было одобрено Комиссией по этике Медицинского университета Чунцина (№ 2020003). Письменное информированное согласие было отклонено Комиссией по этике назначенной больницы для возникающих инфекционных заболеваний.
Сводка отчетности
Дополнительная информация о дизайне исследования доступна в отчете о научных исследованиях природы, связанном с этой статьей.
Доступность данных
Необработанные данные в этом исследовании представлены в дополнительном наборе данных . Дополнительные подтверждающие данные доступны от соответствующих авторов по запросу. Все запросы на необработанные и проанализированные данные и материалы будут рассмотрены соответствующими авторами, чтобы проверить, подпадает ли этот запрос под какие-либо обязательства в отношении интеллектуальной собственности или конфиденциальности. Исходные данные для рис. 1 и расширенные данные рис. 1 и 5 доступны онлайн.







 Уровни IgG у 19 пациентов, перенесших сероконверсию IgG во время госпитализации, достигли плато через 6 дней после первого положительного измерения IgG (расширенные данные, рис. 3 ). Уровень плато IgG варьировал в широких пределах (более чем в 20 раз) у пациентов. IgM также показал аналогичный профиль динамических изменений (расширенные данные рис. 4 ). Мы не обнаружили никакой связи между уровнем плато IgG и клиническими характеристиками пациентов (расширенные данные, рис. 5a – d).). Далее мы проанализировали, подходят ли критерии подтверждения инфекции MERS-CoV, рекомендованные ВОЗ, включая (1) сероконверсию или (2) четырехкратное увеличение титров IgG-специфических антител, для диагностики COVID-19 (с использованием парных образцов из 41 пациент). Первоначальный образец был собран в первую неделю болезни, а второй - через 2-3 недели. Из пациентов, чей IgG был первоначально серонегативным в первую неделю болезни, 51,2% (21/41) перенесли сероконверсию. Всего 18 пациентов были первоначально серопозитивными в первую неделю болезни; из них у восьми пациентов было четырехкратное увеличение вирус-специфических титров IgG (расширенные данные, рис. 6)). В целом, 70,7% (29/41) пациентов с COVID-19 соответствовали критериям сероконверсии IgG и / или четырехкратному увеличению или увеличению титров IgG.
Уровни IgG у 19 пациентов, перенесших сероконверсию IgG во время госпитализации, достигли плато через 6 дней после первого положительного измерения IgG (расширенные данные, рис. 3 ). Уровень плато IgG варьировал в широких пределах (более чем в 20 раз) у пациентов. IgM также показал аналогичный профиль динамических изменений (расширенные данные рис. 4 ). Мы не обнаружили никакой связи между уровнем плато IgG и клиническими характеристиками пациентов (расширенные данные, рис. 5a – d).). Далее мы проанализировали, подходят ли критерии подтверждения инфекции MERS-CoV, рекомендованные ВОЗ, включая (1) сероконверсию или (2) четырехкратное увеличение титров IgG-специфических антител, для диагностики COVID-19 (с использованием парных образцов из 41 пациент). Первоначальный образец был собран в первую неделю болезни, а второй - через 2-3 недели. Из пациентов, чей IgG был первоначально серонегативным в первую неделю болезни, 51,2% (21/41) перенесли сероконверсию. Всего 18 пациентов были первоначально серопозитивными в первую неделю болезни; из них у восьми пациентов было четырехкратное увеличение вирус-специфических титров IgG (расширенные данные, рис. 6)). В целом, 70,7% (29/41) пациентов с COVID-19 соответствовали критериям сероконверсии IgG и / или четырехкратному увеличению или увеличению титров IgG.






